Записи с меткой «азот»
«Открытие» протона
Чем больше рассматриваешь исследования учёных, тем больше в них обнаруживается загадок, возможно, даже странностей. Например, в школьном учебнике Пёрышкина об открытии протона написано: «Резерфорд поставил опыт по исследованию взаимодействия альфа-частиц с ядрами атомов азота. В этом опыте альфа-частица, летящая с огромной скоростью, при попадании в ядро атома азота выбивала из него какую-то частицу».
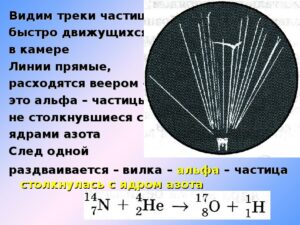
Далее приводится фотография камеры Вильсона. В описании к рисунку сказано: «На рисунке видны расходящиеся веером прямые линии. Это следы альфа-частиц, которые пролетели сквозь пространство камеры, без соударения с ядрами атомов азота. Но след одной альфа-частицы раздваивается, образуя так называемую «вилку». Это означает, что в точке раздвоения трека произошло взаимодействие альфа-частицы с ядром атома азота. В результате чего образовались ядра атомов кислорода и водорода. То, что образуются именно эти ядра, было выяснено по характеру искривления треков при помещении камеры Вильсона в магнитное поле».
Здесь же приводится формула взаимодействия. Рассмотрим её. К ядру атома азота подлетает альфа-частица. В ядре находятся протоны и нейтроны. Вероятность того, что будет выбит протон составляет 50%. То есть либо протон, либо нейтрон. На самом деле ещё меньше, ведь альфа-частица может развалиться на куски, а ядро останется целым.
Теперь прикинем, какова вероятность того, что а-частица прилипнет к ядру. Допустим 33%. Либо прилипнет, либо отскочит, либо развалится на куски и куски как-то себя поведут. Итого, по правилам итоговой вероятности (нам нужно их перемножить), мы получаем примерно 16%. То есть вариант, который описывает формула и при котором альфа-частица выбивает из ядра строго протон и влипает в ядро, имеет вероятность примерно16%. А нам подают её как 100%-ную.
Ещё странность, то что образуется и описано в учебнике, определяют по «характеру искривления треков». Следующая странность – влипание альфа-частицы нам пытаются преподнести как единственно возможное, забывая тот факт, что и альфа-частица, и уж тем более ядро (любого) атома являются объектами с существенно положительными зарядами. Они обязаны отталкиваться.
Всё становится ещё загадочнее, если посмотреть, как был открыт нейтрон. Нас убеждают, что нейтроны выбиваются со строго 100%-ной вероятностью, если обстреливать бериллий… альфа-частицами. При этом она, опять же со строгой 100%-ной вероятностью, прилипает к ядру атома бериллия! Как альфа-частица узнаёт, какую частицу в данном эксперименте выбивать, протон или нейтрон?
Это были лишь цветочки, ягодки – впереди. Внимательно посмотрите на рисунок и сопоставьте с этой цитатой: «было выяснено по характеру искривления треков при помещении камеры Вильсона в магнитное поле».
Иными словами, для того чтобы понять, что в результате взаимодействия получена положительно заряженная частица протон, камеру Вильсона поместили в магнитное поле. Однако в этом случае заряженная частица полетит в определённую сторону и её трек будет криволинейным.
Об этом ранее заявил учебник: «Если поместить камеру Вильсона в магнитное поле, то траектории заряженных частиц искривляются». Теперь, внимание, вопрос: «Каким образом альфа-частицам на рисунке удаётся сохранять прямолинейные треки?» Они ведь положительно заряженные! По крайней мере, нам так говорят.
Либо на рисунке представлен эксперимент, при котором камера Вильсона находилась вне магнитного поля. В таком случае одному Богу известно, что за частицы вылетают при соударении. Либо прямолинейные треки – это нейтральные частицы (без заряда).
Очень похоже на то, что открытие протонов и нейтронов – обман. Формула под рисунком напоминает вывод Э.А. Позднякова о воде. У него азот – это вещество, углеводородная группа непредельного ряда СН2. Её, по аналогии с метаном предельного ряда, можно было бы назвать «метиленом».
Вероятно, в камере Вильсона очень устойчивое химическое соединение двух элементов, которое называют азотом, расщепляется на углерод и водород.
Краткое изложение статьи блогера hajoh-livejournal_com.
И это всё азот?
Как выплеснули ребёнка вместе с грязной водой
В 1772 году химик Даниэль Резерфорд (различать с физиком Эрнестом Резерфордом) исследовал и описал свойства азота. Лавуазье установил, что воздух состоит из смеси двух газов – азота и кислорода. Он написал в 1774 году труд «Анализ атмосферного воздуха».
Для азота были установлены следующие свойства: бесцветный газ, без запаха, мало растворим в воде, в химическом отношении инертен. Кроме того, при обычной температуре исчезает способность вступать в соединения.
Угнетает дыхание, за что и получил своё название – «безжизненный» (от греч. а – отрицательная частица и zoos – живой).
Совершенно естественно, что газ с такими свойствами, химики «эпохи Лавуазье» признали однородным по составу. По какой-то причине, учёные отказались разбираться в аномальных свойствах азота. Во-первых, у него странный атомный вес.
Атомные веса лёгких атомов выражаются формулами или 4п или 4п+3, где п – целое число. Например, атомные веса кислорода и углерода выражаются формулой 4п. Атомный вес кислорода равен 16, то есть здесь п=4 (4×4= 16). Атомный вес углерода равен 12, здесь п=3 (4×3 = 12). Таким элементам как фтор, фосфор и др. отвечает формула 4п+3. Атомный вес фтора, например, равен 19; следовательно, принимая п=4, получим (4 х 4) + 3 = 19).
Азот – единственный элемент, отказавший подчиниться этим формулам. Атомный вес азота (14) приходится особо выражать персональной формулой 4п+2.
Вторая загадка обнаружилась, когда Эрнест Резерфорд стал бомбардировать азот альфа-частицами. Он выяснил, что возникающие при этом атомы с большим пробегом являются атомами водорода. На это указывали величина их пробега и яркость возбуждаемых ими искрений. Это происходило в химически чистом азоте! Он это объяснил без раздумий «аномалией азота».
Это уже переход от науки к религии, в которой поклоняются святому Лавуазье. Любой физик-экспериментатор, а тем более Резерфорд, должен был сделать вывод, что азот – это молекула, в которой присутствует водород.
Рассмотрим формулы рядов углеводородов в порядке возрастающего числа атомов углерода в их молекулах:
Предельные углеводороды: метан – СН4, этан – С2Н6, пропан – С3Н8, бутан – С4Н10 и т.д.
Непредельные углеводороды: Х? – Y?, этилен – С2H4, пропилен – С3Н6, бутилен – С4Н8 и т.д.
В ряду непредельных углеводородов сразу же бросается в глаза явная аномалия. В нём отсутствует первый член, соответствующий метану предельного ряда. Все вещества обоих рядов, кроме первого, существуют в природе. Учёные утверждают, что по загадочным причинам, отсутствует сама разность, то есть группа СН2. Её, по аналогии с метаном предельного ряда, можно было бы назвать «метиленом».
Что помешало обнаружить это соединение? Возможно, группа СН2 отсутствует в природе. Или группа СН2 есть, но у неё такие свойства, что её трудно выявить.
Допустим, что группа СН2 существует. В таком случае она представляет собой газ без цвета и запаха, без химической активности, и без возможности растворимости в воде. То есть его сложно обнаружить и разложить. Смотрим свойства азота и сравниваем.
Скорее всего, данное вещество отказались искать (специально или ошиблись?). Его объявили отсутствующим. При этом исходили из следующих теоретических соображений. Каждый атом углерода имеет четыре единицы валентности, за счёт которых он может присоединять к себе другие атомы или атомные группы. Водород же одновалентен. Следовательно, атом углерода может присоединить 4 атома водорода.
Формула СН2 нарушает рамки теории, поскольку углерод в этом случае сохраняет две свободные валентные связи. Поэтому химики отказали этой группе в самостоятельном существовании. Но почему тогда они разрешили существовать окиси углерода СО, где углерод двухвалентен?
Если рассматривать азот как группу СН2, т.е. как молекулу, то исчезает аномалия его атомного веса. Молекулярный вес группы СН2, как и атомный вес того, что называется азотом, равен 14 (атомный вес углерода 12 + атомные веса двух атомов водорода 1 + 1, в сумме = 14).
Широкое распространение группы СН2 в органических соединениях, а также принципиальная возможность её существования (по аналогии с CO) в свободном состоянии, позволяет предположить, что она действительно существует именно в свободном состоянии.
Вероятно, углеводородную группу СН2 (органическое вещество) ошибочно приняли за элементарный газ – Азот.
Краткое изложение статьи блогера hajoh, написанной по материалам книги Позднякова «Загадки науки».
P.S. Остаётся ещё один вопрос. Случайно или специально отказали в существовании органическому веществу – углеводородной группе СН2?
Больше похоже на злой умысел. Дальнейшие расследования покажут, что это было – ошибка или умысел.
Азотный барьер
Круговорот азота требуется для жизни на Земле. Соединения азота играют важную роль в обмене веществ живых организмов. Много органических молекул в организме растений, животных и людей включают соединения азота (например, аминокислоты, протеины и ДНК). Соединения азота также участвуют в химических процессах в атмосфере и возможно, воздействуют на систему климата.
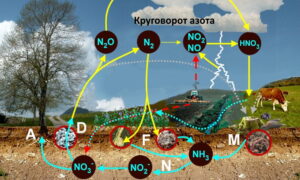
На рисунке «Круговорот азота» показана схема азотного цикла: А – ассимиляция растениями, F – фиксация азота бактериями в симбиозе с растениями или бактериями, живущими в почве, N – нитрификация, D – денитрификация, М – минерализация.
Конский и коровий навоз, человеческий фактор и птичье гуано – это комплексные удобрения. Они содержат все нужные для растений микроэлементы — фосфор, калий, натрий и азот. Но человечество «посадили» на промышленные удобрения.
В отличии от фосфора, азот избежал «азотной ямы», так как у него есть много газообразных соединений. Например, молекулярный азот, которого примерно 4/5 от всей массы атмосферы и вредные окислы азота, которые выбрасывают наши транспорт и промышленность. Поэтому естественное стекание азота в различные ямы нашей гидросферы и литосферы гораздо ниже, чем у фосфора. Кроме того, содержание азота в почве можно восстановить с помощью азотфиксирующих бактерий.
Однако, у растений отсутствует возможность усваивать азот в его газообразной форме. Для усвоения азота он должен быть переведён в водорастворимые формы: в вид нитритов NO2-, нитратов NO3- или иона аммония NH4+. Этим занимается группа бактерий-азотфиксаторов и бактерий-нитрификаторов.
Другая группа бактерий (бактерии-денитрификаторы) занимается разложением водорастворимых форм азота обратно на молекулярный азот, замыкая этот кругооборот. И вот с ними связана основная проблема азотного цикла, которая получила название азотного барьера.
Всё дело в том, что для процесса азотфиксации бактериям нужна энергия. Эту энергию бактерии берут из питательных веществ, которые содержатся в самой почве. Поэтому в почве должен иметься строго определённый объём азота, который рассчитывается на единицу площади поверхности плодородной земли.
Микроорганизмы, в зависимости от вида почв и климата, переводят за год на гектар в водорастворимые формы всего лишь от 20 до 200 килограмм атмосферного азота. Окислительные процессы в природе при высоких температурах – это важные пути естественного производства оксидов азота. Это происходит во время лесных пожаров, извержениях вулкана или разрядах молнии. Например, от 1 до 30 килограмм азота на гектар добавляют дожди за счёт образования соединений азота в разрядах молний (возможно, для этого они и нужны?). Что интересно, если дожди кислотные, то азота они добавляют больше.
Таким образом, основная масса азота, содержащегося в населяющих нашу планету организмах, своим происхождением обязана именно биологической азотфиксации и составляет около 17,2х10 в 7-ой степени тонн в год, что в настоящее время в четыре раза превышает мировое промышленное производство аммиака.
Однако весь этот объём равномерно распределён по всей поверхности и биосфере, в то время, как человечество уже наполовину состоит из азота биологической фиксации, а наполовину – из жуткого, химического азота, полученного в результате процесса Габера. Именно этот процесс, изобретённый немецким химиком Фрицем Габером, позволил человечеству на время выскользнуть из-под проклятия азотного барьера.
Во время этого процесса, образуется аммиак из водорода и атмосферного азота (в условиях высоких температур и высокого давления, а также в присутствии катализатора).
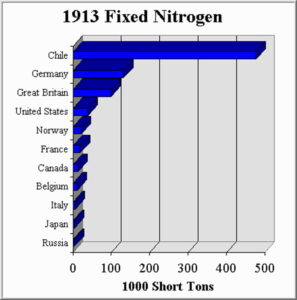
К 1913 году основным поставщиком связанного азота в мире были Чили. Там были обнаружены, вдобавок к залежам гуано, ещё и громадные месторождения природной селитры. Сейчас Чили, благодаря залежам селитры в пустыне Атакама контролирует мировой рынок йода. В 1913 году Чили контролировала плодородие почв повсюду в мире, обладая практической монополией на производство и фосфорных, и азотных удобрений, пороха и взрывчатых веществ (возможно, с этим связаны все политические события и перевороты в этой стране?).
От такого монополизма больше всего страдала Германия. Возможно, из-за монополизма Чили в деле снабжения мира азотом и фосфором и активности США в этой сфере, была предпринята попытка Германии аннексировать островное государство Науру (может быть, и 1 мировая война была связана с рынком азота и фосфора?).
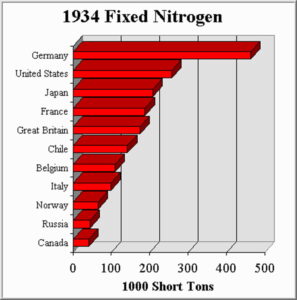
Процесс Габера-Боша позволил Германии, в отсутствии своих источников минерального азота, развернуть масштабное производство аммиака. К 1934 году Германия вырывается вперёд в деле производства соединений азота. Рынок азота разительно меняется. Месторождения селитры в Чили отходят на второй план, давая к 1934 году лишь 7,2% производства азота, вместо 56,5%, которые они занимали в 1913 году. Синтетический аммиак, полученный в процессе Габера-Боша к 1934 году занимает 63,8% рынка (ещё повод, чтобы уничтожить Германию).
Как утверждают учёные, человечеству требуется значительно больше азота и фосфора. Их производство зависит от температуры и исходного сырья. Процесс Габера эффективно идёт при температурах от 300 до 550 °C.
Для получения суперфосфата (основного фосфорного удобрения) тоже требуется процесс обжига, который надо осуществлять при температуре от 320 °C до 980 °C. Чем выше температура обжига, тем большее количество фосфора переходит в водорастворимые формы.
Основным сырьём для производства аммиака является водород, который легко получить из жирных углей, природного газа или даже из нефти. При помощи дров, ветра и солнца водород можно получить только путём весьма затратной процедуры электролиза воды. Решить эту проблему могут ядерные реакторы. Реакторы с газовым охлаждением с теплоносителем-углекислым газом позволили получать температуры в 650 °C. Коммерческие газоохлаждаемые реакторы в настоящее время используются только в Великобритании (кто мешает другим их построить?).
Многие государства заинтересованы в постройке реакторов с гелиевым теплоносителем. Они имеют сверхвысокую эффективность термодинамического цикла по производству электричества, и могут обеспечивать получение температур теплоносителя первого контура в пределах 900-1000 °C. Получение таких температур позволит обеспечить все нужды химической индустрии по получению сырья для производства фосфора, растворимого азота и проведения всех реакций до конечного продукта – готовых азотных и фосфорных удобрений. С такими реакторами можно легко получать водород и фосфор из морской воды и опреснять её (но кто позволит это сделать).
Такие реакторы уже испытывались и строились в 1960-х-1970-х годах в
Великобритании и в Германии. Однако постройка их промышленных аналогов была остановлена (кому они помешали?). В Китае продолжается внедрение таких реакторов.
Краткое изложение статьи crustgroup_livejournal «Азотный барьер, фосфорная яма и сказ о том, как можно просрать насранное».
P.S. Оксиды азота в атмосферных реакциях преобразовываются в азотную кислоту, что вносит свой вклад в кислотные дожди, которые приводят к отрицательным последствиям.
Если внесено слишком много удобрений, то это вызывает отрицательное воздействие. Аммиак и нитраты смываются в водоёмы и прибрежные зоны. Здесь они вызывают сильный рост растений и морских водорослей (фитопланктона), и в результате жизнь в воде может быть уничтожена из-за уменьшения содержания кислорода.